Васильева И.Н., Беспалов В.Г., Семенов А.Л., Точильников Г.В.
Опыт доклинического и клинического изучения внеклеточной ДНК при различных патологиях
ФГБУ «НМИЦ онкологии им. Н.Н.Петрова» Минздрава России, Россия, 197758, Санкт-Петербург, пос. Песочный, ул. Ленинградская, 68. Университет ИТМО, 191002, Санкт-Петербург, ул. Ломоносова, д. 9
Резюме
В обзоре представлены результаты собственных экспериментальных исследований внеклеточной ДНК (вкДНК) после воздействия ионизирующей радиации и низкочастотного шума, для изучения механизма действия витаминов, у животных с доброкачественной гиперплазией предстательной железы; а также клинических исследований у больных с острыми нарушениями мозгового кровообращения и хроническими заболеваниями бронхолегочной системы. Рассматриваются возможности применения тестов определения вкДНК для малоинвазивной диагностики различных патологий, мониторинга заболеваний, изучения механизмов действия и индивидуальной чувствительности к лекарственной терапии.
Ключевые слова: внеклеточная ДНК, нуклеосомы, апоптоз, патологии.
Вопросы биологической, медицинской и фармацевтической химии. – 2019. – Т. 22, № 10. – С.50-56. (На русском языке).
<<<>>>
Vasilyeva Irina Nikolaevna, Bespalov Vladimir Grirorievich, Semenov Alexander Leonidovich, Tochilnikov Grigory Viktorovich
Experience of preclinical and clinical study of extracellular DNA in various pathologies
Petrov National Medical Research Center of Oncology, Saint Petersburg, Russia. ITMO University, Saint Petersburg, Russia
Summary
Our experimental and clinical studies revealed changes in the content of extracellular DNA (exDNA) in the blood plasma for various pathologies. Ionizing irradiation of rats causes an increase in the content of nucleosomal exDNA in proportion to the radiation dose. Sequencing of exDNA of the irradiated rats shows that this exDNA is released from various parts of the genome and various tissues. Low-frequency noise in single or repeated exposure leads to increase in the content of exDNA, significantly greater in chronic acoustical exposure. Consequently, ionizing radiation and low-frequency noise increase the apoptosis of cells. Administering to rats a combination of vitamins A and E before irradiation raises the level of exDNA, this pro-apoptotic effect of vitamins explains their radioprotective effect as a result of the death of damaged cells. The exDNA level is significantly increased in old intact male rats in comparison with young male rats; exDNA level does not change with testosterone induction of benign hyperplasia of the prostate (BPH) in the young rats, whereas in the old rats increases significantly, which indicates the intensification of apoptosis processes with age and with the development of BPH in old animals. The content of exDNA is increased within 3 days after an acute period in patients with acute impairment of cerebral circulation, and dynamics of change of exDNA levels in patients with ischemic and hemorrhagic stroke is different, which can be used both: to assess the severity of brain damage, and for differential diagnosis of various types of strokes. In patients with COPD the content of exDNA decreases during remission, which indicates the reduction of cell death in the lungs and the reduction of inflammatory process. Thus, the finding of exDNA in blood plasma can be used for the diagnosis of various pathologies, monitoring and evaluating the effectiveness of treatment.
Key words: extracellular DNA, nucleosomes, apoptosis, pathologies.
<<<>>>
УДК 616-021 – 577.24
1Васильева И.Н. (кандидат биологических наук), 1,2 Беспалов В.Г. (доктор медицинских наук), 1Семенов А.Л., 1Точильников Г.В. (кандидат медицинских наук)
Опыт доклинического и клинического изучения внеклеточной ДНК при различных патологиях
- 1 - ФГБУ «НМИЦ онкологии им. Н.Н.Петрова» Минздрава России, Россия, 197758, Санкт-Петербург, пос. Песочный, ул. Ленинградская, 68
- 2 - Университет ИТМО, 191002, Санкт-Петербург, ул. Ломоносова, д. 9
Феномен циркуляции ДНК в биологических жидкостях человека и животных известен давно, однако в настоящее время активно ведутся исследования внеклеточной ДНК (вкДНК) в рамках разработки методов минимально инвазивной диагностики, в качестве замены или дополнения тканевой биопсии. Такие исследования основаны на определении специфичных участков вкДНК крови и других биологических жидкостей. Они находят практическое применение в неонатологии для определения пола, группы крови и наличия хромосомных болезней плода, а в области онкологии исследование вкДНК позволяют преодолеть ограничения, связанные с гетерогенностью и пластичностью опухоли, и отражает динамику индивидуальной биологии опухоли [1].
Получены данные об источнике происхождения, функции и структуре вкДНК [1, 2, 3]. Основное количество вкДНК образуется в результате гибели клеток и циркулирует в виде апоптозных телец; активированные клетки выделяют ДНК в составе микровезикул, а покоящиеся ‒ в составе экзосом. Мембранные частицы, несущие нуклеиновые кислоты, имеют несколько механизмов связывания с циркулирующими в крови клетками: нуклеиновые кислоты могут оставаться обратимо связанными с клеточной поверхностью, могут быть инкорпорированы в клетки в результате опосредованного рецепторами пути или в результате слияния частиц с клеточными мембранами [4]. Функцией вкДНК считают участие в иммунном ответе и злокачественной трансформации клеток [1, 2, 3]. Продемострировано поглощение вкДНК культуральными клетками с последующей интеграцией в хроматин хозяина [5]. Секвенирование вкДНК доказало ее происхождение преимущественно из ДНК генома [2, 3, 6]. Представленность ДНК генома в плазме крови у человека исследована методом глубокого секвенирования и определения позиционирования нуклеосом, в результате показано лимфоидное и миелоидное происхождение вкДНК у человека в норме [3, 7, 8].
Исследование внеклеточной ДНК в плазме крови облученных животных
Началом нашей работы было исследование содержания вкДНК в плазме крови экспериментальных животных после воздействия ионизирующей радиации [9]. Определение вкДНК проводили в плазме крови спектрофлуориметрическим методом [9]. Было обнаружено, что после облучения в дозах от 2 до 100 Гр концентрация вкДНК в плазме крови возрастала с увеличением дозы, и это наблюдалось для временного интервала от 1 часа до 3 дней. Концентрации вкДНК были наибольшими через 5 часов после облучения в дозах от 8 до 100 Гр.
При электрофоретическом разделении вкДНК плазмы крови четко различимы ее основные фракции: высокомолекулярная, 3,5-6 тыс. п.н., и низкомолекулярная, нуклеосомного размера, 160-180 п.н. Содержание нуклеосомной вкДНК значимо возрастало с увеличением дозы облучения: до 20 Гр зависимость была прямо пропорциональная, от 20 до 100 Гр – логарифмическая [2, 6, 9]. Получены уравнения линейной и логарифмической регрессии, позволяющие достоверно рассчитать дозу облучения по содержанию нуклеосомной внДНК [2, 9]. Известно, что лучевая патология во многом определяется процессами программированной клеточной гибели: белок Р53 блокирует клеточный цикл в фазе G1, стимулирует репарационные процессы, а если активность репарационных систем недостаточна, то модулирует апоптоз, защищая организм от появления мутантных клеток [2, 6, 9].
Возникли предположения, что, во-первых, содержание нуклеосомной вкДНК в плазме крови увеличивается при экспериментальных воздействиях и заболеваниях, механизм патогенеза которых связан с усилением процессов программированной клеточной гибели. Во-вторых, экспериментальные воздействия различной степени тяжести могут вызывать зависимые от дозы изменения количества нуклеосомной вкДНК крови. И, в-третьих, исследование уровня нуклеосомной вкДНК крови и других биологических жидкостей позволит оценивать роль клеточной гибели в развитии патологического процесса. Увеличение количества нуклеосомной вкДНК свидетельствует об усилении процессов апоптоза, а уменьшение – об их ингибировании.
Секвенирование нуклеосомной внеклеточной ДНК плазмы крови облученных крыс
Была секвенирована нуклеосомная вкДНК крови крыс после воздействия ионизирущего облучения в дозах 8 и 100 Гр, приводящих к возникновению различных форм лучевой болезни – костно-мозговой и церебральной, соответственно. Для этого нуклеосомную фракцию (160-180 п.н.) вкДНК от облученных крыс элюировали из геля после электрофореза. Очищенную вкДНК клонировали в E.coli в фазмиде Bluescript M13+ и секвенировали по Сенгеру [2, 6]. Анализ 80 полученных рекомбинантных клонов показал, что после облучения в дозе 8 Гр длина вставки вкДНК составляла 123-180 п.н., а после облучения 100 Гр – 80-400 п.н. [6]. Увеличение разброса свидетельствует о более значительном повреждении ДНК (двунитевые разрывы) после воздействия в дозе 100 Гр. Вне зависимости от дозы во вкДНК обнаружено повышенное содержание G/C-пар: 49% против 44% в референсном геноме грызунов [2, 6]. Исследование по программе RECON подтвердило вероятность формирования нуклеосом для секвенированной вкДНК облученных крыс. Эта вероятность определяется чередованием G/C-обогащенных участков приблизительно через каждые 10 п.н. с динуклеотидом ApT, определяющим оптимальное для позиционирования нуклеосом искривление молекулы ДНК [2]. Значимые различия обнаружены в распределении динуклеотидов. В геноме среднее содержание СрG составляет 1,2%, а СрТ – 7,0%, в отличие от 6,2% при случайном распределении. В нуклеосомной вкДНК крыс, облученных в дозе 8 и 100 Гр содержание СрG составляет 0,7 и 1,7%, а СрТ – 9,6 и 7,8%, соответственно [2, 6]. Наше предположение о выделении вкДНК после облучения в дозах 8 или 100 Гр из различных типов тканей вполне закономерно, поскольку современные исследования показывают возможность определять тканевую принадлежность на основании тканеспецифичного паттерна метилирования ДНК и особенностей позиционирования нуклеосом [7, 9].
Скрининг сиквенсов вкДНК по банку данных показал их гомологию участкам генома грызунов [6]. К настоящему времени геном грызунов считают собранным, за исключением пропусков размером до 3 Мб, соответствующим участкам сателлитной ДНК [2, 6]. Остается предположить, что идентифицированные с низкой вероятностью клоны принадлежат к неаннотированным последовательностям сателлитов.
К настоящему времени исследованы сиквенсы вкДНК здоровых доноров, беременных женщин, больных раком простаты, культуральной среды HUVEC и облученных крыс [2]. Обнаружено, что вкДНК представлена ДНК генома, позиционирует нуклеосомы, обогащена G/C-парами и элементами повторов. Полагают, что эти особенности обусловлены свойствами ДНК в кровотоке или механизмом апоптоза.
Работы по исследованию вкДНК при радиационных воздействиях проводятся некоторыми другими исследователями и, наряду с использованием в дозиметрии, нашли теоретическое продолжение. Так, обнаружено, что выделяемая гибнущими клетками вкДНК содержит значительную часть окисленных нуклеотидов, и эта окисленная ДНК опосредует эффект свидетеля и адаптивный эффект [2]. Показано, что хроматин, выделяемый из умирающих клеток, способен встраиваться в хромосомы, приводя к увеличению репарационных процессов [5]. Впервые выявленное нами повышение содержания вкДНК через 5 ч после облучения с последующим снижением через 1 сут. может использоваться в качестве показателя эффективности лучевой терапии онкологических больных, в том числе применимо для ее новых методов, таких как селективная внутренняя радиотерапия с адресной доставкой меченых микросфер [2].
Исследование нуклеосомной внеклеточной ДНК для оценки механизма действия лекарственных средств
Нами изучена апоптотическая активность α-токоферола ацетата (витамин Е) и аскорбиновой кислоты (витамин С) у крыс, подвергавшихся воздействию ионизирующей радиации. Животным вводили однократно перорально комбинацию витаминов Е и С в профилактических дозах до или после общего однократного гамма-облучения 8 Гр, вызывающей костномозговую форму лучевой болезни. Апоптотическое действие оценивали по уровню циркулирующей вкДНК в плазме крови через 5 ч после общего облучения животных. Комбинация витаминов Е и С при введении за 10 мин до облучения в дозе 8 Гр значимо увеличивало содержание вкДНК в крови. Таким образом, радиопротекторный эффект смеси витаминов Е и С объясняется ее апоптотическим действием [10].
Нуклеосомная внеклеточной ДНК для оценки вредного воздействия низкочастотного шума
Наши исследования показали, что содержание нуклеосомной вкДНК значимо увеличивалось в результате действия низкочастотного шума (НЧШ) [11]. Через 1 сутки после однократного действия НЧШ с максимальным диапазоном 250 Гц и уровнем звукового давления 120 дБ или 150 дБ было обнаружено 7,6-кратное повышение содержания нуклеосомной вкДНК в плазме крови крыс по сравнению с животными, не подвергавшимися воздействию НЧШ. Повышенное содержание вкДНК сохранялось не менее 7 дней. Воздействие НЧШ в течение 13 недель по 17 мин 5 раз в неделю вызывало дальнейшее повышение содержания нуклеосомной вкДНК в плазме крови [11]. Известно, что острое воздействие НЧШ проявляется структурными нарушениями во внутренних органах крыс, преимущественно в легких, и изменениями клеток крови [11]. Хроническое действие НЧШ вызывает структурные изменения, характерные для очаговой эмфиземы легких по геморрагическому типу с изменениями состояния клеток крови. Наши результаты позволяют предположить, что воздействие НЧШ вызывает развитие патологического процесса с участием массированной клеточной гибели. Возможно, акустические воздействия представляют собой значительно более вредный фактор, чем представлялось ранее [11, 12].
Исследование содержания внеклеточной ДНК в крови молодых и старых крыс при индукции доброкачественной гиперплазии предстательной железы
Нами изучено содержание вкДНК в плазме крови молодых (возраст 3 месяца) и старых (возраст 2 года) самцов крыс с индуцированной доброкачественной гиперплазией предстательной железы (ДГПЖ) в сравнении с интактными молодыми и старыми животными [13]. ДГПЖ индуцировали с помощью введения пролонгированного препарата тестостерона после кастрации. Содержание вкДНК в плазме крови определяли сэндвич-иммуноферментным анализом (Cell Death Detection ELISA PLUS Kit, Roche). У интактных старых самцов крыс по сравнению с молодыми обнаружено значимое увеличение уровня вкДНК. У пожилых людей также отмечается повышенный уровень вкДНК в крови по сравнению с молодыми; у пожилых людей вкДНК выделяется не только в связи системной потерей клеток, но и в результате хронических воспалительных процессов [14, 15]. Через 1 месяц от начала введения тестостерона как у старых, так и молодых крыс, развивалась ДГПЖ, что проявлялось увеличением всех долей простаты и гиперплазией ацинусов и мышечной ткани при морфологическом исследовании по сравнению с интактными животными, при этом у старых крыс степень ДГПЖ была значимо выше, чем у молодых. Мы наблюдали различные реакции на введение экзогенного тестостерона молодым и старым животным. У молодых крыс с увеличением уровня тестостерона в крови содержание вкДНК не изменялось значимо, тогда как у старых крыс при том же уровне тестотерона в крови содержание вкДНК было существенно выше, чем у молодых животных. Согласно общепринятым представлениям, в основе развития ДГПЖ лежит снижение апоптоза в тканях простаты [16], однако к появлению в кровотоке вкДНК может привести формирование провоспалительного фенотипа из-за присутствия в тканях большого количества дефектных клеток, а также ишемического некроза и сопутствующих процессов апоптоза. Таким образом, мы впервые выявили, что у старых крыс при развитии ДГПЖ наблюдается усиление гибели клеток в тканях, проявляемой в увеличении содержания вкДНК, с одновременным ингибированием апоптоза и усилением пролиферации клеток в тканях простаты [14]. Полученные нами результаты обосновывают возможность применения вкДНК в качестве диагностического критерия при исследовании состояния здоровья пожилых мужчин с ДГПЖ.
Исследование нуклеосомной внеклеточной ДНК у больных с острым нарушением мозгового кровообращения
Клиническое исследование показало, что острое нарушение мозгового кровообращения характеризуется повышением содержания нуклеосомной вкДНК в течение 3 суток после острого периода [6, 9]. В случае геморрагического инсульта максимальное увеличение содержания нуклеосомной вкДНК в плазме крови отмечено через 3 ч после начала болезни, а в случае ишемического – через 24 ч. Аналогичная фракция вкДНК в том же количестве была обнаружена в спинномозговой жидкости больных с ишемией [6, 9]. Наши результаты и данные литературы обосновывают возможность использования определения нуклеосомной вкДНК для дифференциальной диагностики острого нарушения мозгового кровообращения по ишемическому или геморрагическому типу на ранних стадиях заболевания, а также подтверждают роль апоптоза в развитии инсультов и могут служить показателем тяжести повреждения головного мозга [6, 17, 18].
Нуклеосомная внеклеточной ДНК у больных с хроническими заболеваниями бронхолегочной системы
В наших исследованиях у больных хронической обструктивной болезнью легких (ХОБЛ) в состоянии ремиссии отмечено пониженное содержание нуклеосомной вкДНК в плазме крови по сравнению больными хроническим необструктивным бронхитом (ХНБ) и здоровыми донорами, причем содержание нуклеосомной вкДНК у больных ХНБ и здоровых доноров не различалось достоверно [6, 19]. Были обследованы также родственники первой линии пациентов ХОБЛ и ХНБ, содержание нуклеосомной вкДНК у них не различалось значимо и не отличалось от содержания у здоровых доноров [19]. У больных ХОБЛ в возрасте 60-80 лет по сравнению с больными ХОБЛ 45-59 лет наблюдалась тенденция к увеличению содержания нуклеосомной вкДНК, однако ее содержание было значимо ниже, чем у здоровых доноров того же возраста. Возрастные увеличения уровня вкДНК отмечены другими авторами [14, 15]. Снижение содержания нуклеосомной внДНК в крови у пациентов ХОБЛ в ремиссии согласуется с общими представлениями о снижении апоптоза в патогенезе развития заболевания [2, 6]. Если обострение ХОБЛ характеризуется усилением апоптоза в легочной ткани, то при ремиссии могут происходить восстановительные процессы в легочной ткани, когда процессы регенерации преобладают над процессами апоптоза [19]. Снижение уровня нуклеосомной вкДНК у больных ХОБЛ соответствует современным представлениям о происхождении значительной ее части из нейтрофилов (эозинофилов, тучных клеток, макрофагов) в результате нетоза в ответ на провоспалительные агенты [3]. Снижение уровня вкДНК при ХОБЛ в ремиссии сопровождается снижением уровня нейтрофилов [20].
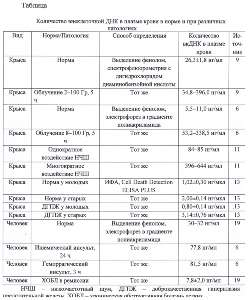
Количественные показатели содержания вкДНК в плазме крови, полученные в наших экспериментальных и клинических исследованиях, приведены в Таблице.
Заключение
Уровень вкДНК отражает процесы апоптоза в организме. В проведенных нами экспериментальных и клинических исследованиях выявлены изменения содержания вкДНК в плазме крови при различных патологиях. Ионизирующее облучение крыс вызывает увеличение содержания нуклеосомной вкДНК пропорционально дозе облучения. Секвенирование вкДНК облученных крыс показывает, что вкДНК выделяется из различных участков генома и различных тканей. НЧШ как при однократной, так и при многократной экспозиции приводит к увеличению содержания вкДНК, значимо большему при хроническом акустическом воздействии. Следовательно, ионизирующая радиация и НЧШ усиливают апоптоз клеток. Введение крысам перед облучением комбинации витаминов А и Е повышает уровень вкДНК, данный проапоптотический эффект витаминов объясняет их радиопротекторное действие в результате гибели поврежденных клеток. У старых интактных крыс самцов уровень вкДНК значимо повышается по сравнению с молодыми самцами крыс; при индукции ДГПЖ тестостероном у молодых крыс уровень вкДНК не меняется, тогда как у старых значительно увеличивается, что говорит об усилении процессов апоптоза с возрастом и при развитии ДГПЖ у старых животных. У больных с острым нарушением мозгового кровообращения содержание вкДНК увеличено в течение 3 сут. после острого периода, причем динамика уровней вкДНК у больных с ишемическим и геморрагическим инсультом разная, что может использоваться как для оценки тяжести повреждения головного мозга, так и для дифференциальной диагностики различных типов инсультов. У пациентов с ХОБЛ в период ремиссии содержание вкДНК снижается, что говорит об уменьшении гибели клеток в легких и ослаблении воспалительного процесса. Таким образом, определение вкДНК в плазме крови может быть использовано для диагностики различных патологий, мониторинга и оценки эффективности лечения.
Литература
1.Aucamp J., Bronkhost A.J., Badenhorst C.P.S., Pretorius R.J. The diverse origins of circulating cell-free DNA in the human body: a critical re-evaluation of the literature. Biological Reviews Cambridge Philosophical Society. – 2018; 93:1649–1683.
2. Васильева И.Н., Подгорная О.И., Беспалов В.Г. Нуклеосомная фракция внеклеточной ДНК как показатель апоптоза // Цитология. – 2015; 57: 87–94.
3. Thierry A.R., Messaoudi S.El., Gahan P.B. et al. Origins, structures, and functions of circulating DNA in oncology // Cancer Metastasis Rev. – 2016; 35:347–376.
4. Rykova E.Y., Morozkin E.V., Ponomareva A.A. et al. Cell-free and cell-bound circulating nucleic acid complexes: mechanisms of generation, concentration and content // Expert Opin. Biol. Ther. – 2012; 12(S1):S141–S153.
5. Mittra I., Khare N.K., Raghuram G.V. et al. Circulating nucleic acids damage DNA of healthy cells by integrating into their genomes // Journal of Biosciences. – 2015; 40:91–111.
6. Васильева И.Н., Зинкин В.Н. Значение низкомолекулярной ДНК плазмы крови в диагностике патологических процессов различного генеза. // Биомедицинская химия. – 2013; 59:358–373.
7. Зинкин В.Н., Васильева И.Н., Вознюк И.А. Определение внеклеточной низкомолекулярной ДНК в крови как диагностический метод для клинических и экспериментальных исследований // Авиакосмическая и экологическая медицина. – 2011; 5:47–51.
8. Lehmann-Werman R., Neiman D., Zemmour H. et al. Identification of tissue-specific cell death using methylation patterns of circulating DNA // Proc. Natl. Acad. Sci. USA. – 2016; 113:1826–1834.
9. Snyder M.W., Kircher M., Hill A.J. et al. Cell-free DNA comprises an in vivo nucleosome footprint that informs its tissues-of-origin // Cell. – 2016; 164:57–68.
10. Vasilyeva I., Bespalov V., Baranova A. Radioprotective combination of α-tocopherol and ascorbic acid promotes apoptosis that is evident by release of low-molecular weight DNA fragments into circulation // Intern. J. Radiat. Biol. – 2015; 91:872–877.
11. Vasilyeva I.N., Bespalov V.G., Semenov A.L. et al. The effects of low-frequency noise on rats: evidence of chromosomal aberrations in the bone marrow cells and release of low-molecular-weight DNA in the blood plasma // Noise Health. – 2017; 19:79–83.
12. Antunes E., Oliveira P., Oliveira M.J. et al. Effect of large pressure amplitude low frequency noise in the parotid gland perivasculo-ductal connective tissue // Acta Med. Port. – 2013; 26:229–240.
13. Vasilyeva I.N., Bespalov V.G., Von J.D. et al. Cell-free DNA plasma levels differ in age-specific pattern in healthy rats and castrated with testosterone-induced benign prostatic hyperplasia // Int. J. Genomics. – 2019; 2019:8173630.
14. Zhong X.Y., Hahn S., Kiefer V., Holzgreve W. Is the quantity of circulatory cell-free DNA in human plasma and serum samples associated with gender, age and frequency of blood donations? // Annals of Hematology. – 2006; 86:139–143.
15. Jylhävä J., Nevalainen T., Marttila S. et al. Characterization of the role of distinct plasma cell-free DNA species in age-associated inflammation and frailty // Aging Cell. – 2013; 12:388–397.
16. Gonzaga A.C.R., Campolina-Silva G.H., Werneck-Gomes H. et al. Profile of cell proliferation and apoptosis activated by the intrinsic and extrinsic pathways in the prostate of aging rats // Prostate. – 2017; 77:937–48.
17. Bustamante A., Simats A., Vilar-Bergua A., García-Berrocoso T., Montaner J. Blood/Brain Biomarkers of Inflammation After Stroke and Their Association with Outcome: From C-Reactive Protein to Damage-Associated Molecular Patterns // Neurotherapeutics. – 2016; 3:671–684.
18. O'Connell G.C., Petrone A.B., Tennant C.S. et al. Circulating extracellular DNA levels are acutely elevated in ischaemic stroke and associated with innate immune system activation // Brain Inj. – 2017; 6:1-7.
19. Васильева И.Н., Беспалов В.Г. Низкомолекулярная ДНК плазмы крови у больных хронической обструктивной болезнью легких // Терапевтический архив. – 2017; 3:24–28.
20. Liu J., Pang Z., Wang G. et al. Advanced role of neutrophils in common respiratory diseases // J. Immunol. Res. – 2017; 6710278.
Подписи авторов статьи
"Опыт доклинического и клинического изучения внеклеточной ДНК при различных патологиях":
- Васильева Ирина Николаевна, кандидат биологических наук, старший научный сотрудник научной лаборатории химиопрофилактики рака и онкофармакологии ФГБУ «НМИЦ онкологии им. Н.Н.Петрова»
- Беспалов Владимир Григорьевич, доктор медицинских наук, заведующий научной лабораторией химиопрофилактики рака и онкофармакологии ФГБУ «НМИЦ онкологии им. Н.Н.Петрова»
- Семенов Александр Леонидович, научный сотрудник научной лаборатории химиопрофилактики рака и онкофармакологии ФГБУ «НМИЦ онкологии им. Н.Н.Петрова»
- Точильников Григорий Викторович, кандидат медицинских наук, научный сотрудник научной лаборатории химиопрофилактики рака и онкофармакологии ФГБУ «НМИЦ онкологии им. Н.Н.Петрова»
Переписка:
Васильева Ирина Николаевна, iravasilyeva@hotmail.com , +7 921 903-44-15
Signatures of the authors of the article
"Experience of preclinical and clinical study of extracellular DNA in various pathologies"
- Vasilyeva Irina Nikolaevna, PhD, Senior Researcher, Laboratory of Cancer Chemoprevention and Oncopharmacology, N.N. Petrov National Medical Research Center of Oncology
- Bespalov Vladimir Grirorievich, MD, Head of Laboratory of Cancer Chemoprevention and Oncopharmacology, N.N. Petrov National Medical Research Center of Oncology
- Semenov Alexander Leonidovich, Researcher, Laboratory of Cancer Chemoprevention and Oncopharmacology, N.N. Petrov National Medical Research Center of Oncology
- Tochilnikov Grigory Viktorovich, MD, Researcher, Laboratory of Cancer Chemoprevention and Oncopharmacology, N.N. Petrov National Medical Research Center of Oncology
Correspondence:
Vasilyeva Irina Nikolaevna, iravasilyeva@hotmail.com, +7 921 903-44-15
Отзывы
Разделы, к которым относится эта статья:
| Наука: | Авторские материалы Люди науки |